La fission nucléaire
En quoi la découverte du noyau atomique est-elle une avancée scientifique
et quelles sont ses conséquences sur l'Homme ?
Pour cette première partie, nous verrons ensemble l’aspect théorique de la fission nucléaire. Ainsi, nous commencerons par parler de l’acteur principal de cette fission : le noyau de l’atome (ses caractéristiques, sa découverte). Puis nous verrons comment ce noyau reste lié pour ensuite voir comment le délier (avec la fission, notamment).
Sommaire de la partie I
I. Le Noyau de l'atome
- A. Rappels
- B. La découverte du noyau
- C. L'unité de masse
- A. La cohésion nucléaire
- B. Noyau et énergie
- C. La Courbe d'Aston
- A. Une réaction nucléaire provoquée
- B. Bilan de masse et d'énergie
I. Le noyau de l'atome
A. Rappels
L’atome est la plus petite particule qui conserve les propriétés chimiques d’un élément donné. Il est électriquement neutre. Il est composé de deux parties : le cortège électronique (ce sont les d’électrons qui gravitent autour du centre de l’atome) et le noyau (ce sont les protons et les neutrons).
Electriquement, les électrons sont chargés négativement et les protons positivement, tandis que les neutrons sont, comme leur nom l'indique, neutres.
B. La découverte du noyau
Thomson pensait que l’atome avait une composition qu’on pouvait comparer à un cake, mais en 1991 Rutherford cette idée du “Plum Pudding” en prouvant la présence du noyau au centre de l’atome. Cette découverte est rendue possible grâce à ce montage :
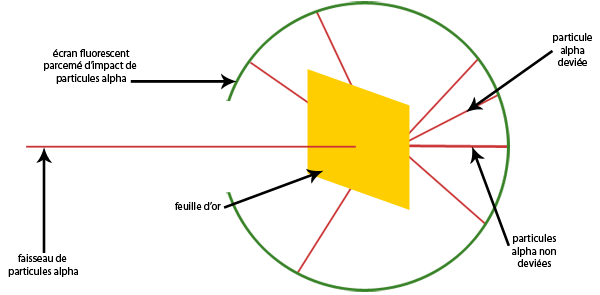
On projette des particules alpha à 17x103 km.s-1 sur une feuille d’or et on étudie le mouvement de ces particules dans le référentiel terrestre.
On constate des impacts sur l’écran fluorescent, ils ne sont pas tous au même endroit. Comme toutes les particules avaient le même mouvement quand on les a lancés et qu’elles sont, à la fin de l’expérience, à des positions différentes, on en déduit qu'elles ont été déviées. On peut même noter que parfois ces particules font demi-tour, ce qui laisse imaginer la présence d’un important obstacle, se trouvant donc dans la feuille d’or.
Les particules alpha sont composés de deux protons et deux neutrons. Avec les connaissances d’aujourd’hui, on sait aussi que l’atome Or, noté Au, possède 197 neutrons, 197 protons et 79 électrons. Nous allons donc calculer la masse de chaque particule de l’expérience.
Un neutron a une masse voisine de 1,673 x 10-27 kg et le proton une masse proche de 1,675 x 10-27 kg. On peut donc trouver la masse d’un noyau Or par le calcul suivant : 197 neutrons x 1,673 x 10-27 kg + 197 protons x 1,675 x 10-27 kg, soit environ 6,596 x 10-25 kg. On peut faire la même chose avec la masse d’une particule alpha : 2 neutrons x 1,673 x 10-27 kg + 2 protons x 1,675 x 10-27 kg, ce qui donne environ 6,696 x 10-27 kg. Enfin, chaque électron gravitant autours du noyau d’Or a une masse équivalente à 9,109 x 10-31 kg.
Revenons à l’expérience. Si la particule alpha rencontre un électron, elle ne peut être dévié car la première a une plus grande masse que l’autre (un peu comme une balle de tennis et une balle de tennis de table). Ce ne sont donc pas les électrons qui sont responsables du changement de trajectoire des particules alpha. De même, le noyau d’Or a une masse plus grande que les particules alpha, donc on dire que si une particule rencontre un noyau d’Or, la première est déviée par la deuxième comme une balle de tennis contre une boule de pétanque.
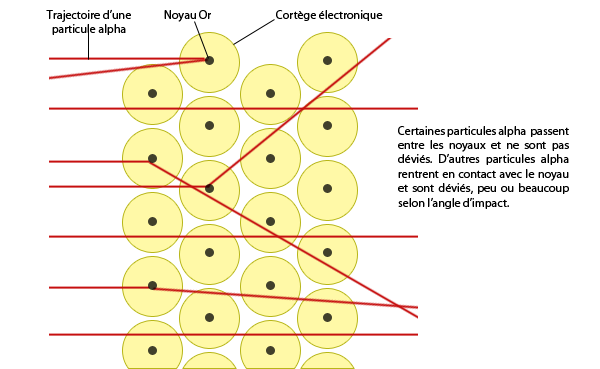
Cette expérience permis ainsi de prouver qu’il y a un élément de masse supérieur aux électrons au centre de l’atome qu’on a nommé le noyau atomique.
C. L'unité de masse
A notre échelle, la masse d’un noyau et très petite. Ainsi, en physique nucléaire, les théoriciens ont inventé une nouvelle unité plus adaptée : l’unité de masse atomique.
L’unité de masse atomique, abrégé u, est le douzième de la masse d’un atome de carbone 12 (c’est-à-dire un atome de 12 nucléons). En d’autres termes, un atome de carbone 12 a une masse de 12 u et 1 mole de carbone 12 a donc une masse de 12g. On en déduit que 1 u = (12 x 10-3 kg) / (12 x Na) avec Na le nombre d’Avogadro. En conséquence, 1 u est voisin de 1,66055 x 10-27 kg.
On en déduit que la masse d’un neutron est mn = 1,008665 u et celle du proton mp = 1,007276 u. Enfin, la masse de l’électron est de me = 5,486 x 10-4 u.
Cette unité de masse n’est, globalement, pas très utilisé, et pourtant elle nous sera très utile pour la fission nucléaire qui fait intervenir la masse des particules.